Менингококковая инфекция — опасное заболевание!
 Менингококковая инфекция занимает особое место в инфекционной патологии, продолжая оставаться актуальной для 150 стран мира, в том числе и для Республики Беларусь, что связано с тяжестью заболевания и регистрацией летальных случаев от данной инфекции.
Менингококковая инфекция занимает особое место в инфекционной патологии, продолжая оставаться актуальной для 150 стран мира, в том числе и для Республики Беларусь, что связано с тяжестью заболевания и регистрацией летальных случаев от данной инфекции.
Самые высокие показатели заболеваемости отмечаются в так называемом «менингитном поясе» Земли – на территории Африки к югу от Сахары, начиная от Сенегала на западе, до Эфиопии на востоке.
В Республике Беларусь эпидемиологическая ситуация по менингококковой инфекции сохраняется на стабильном уровне с тенденцией к снижению. В последние годы менингококковая инфекция относится к редко встречающимся инфекциям (показатель заболеваемости –менее 1 на 100 тысяч населения). Несмотря на современные способы и средства лечения, эта коварная инфекция редко, но уносит жизни, главным образом, малышей.
Основной группой риска являются дети в возрасте до двух лет. Однако можно сказать, что дети всех возрастов заболевают менингококковой инфекцией чаще, чем взрослые.
Возбудителем менингококковой инфекции является бактерия Neisseria meningitidis (менингококк). Существует 18 серогрупп менингококка, три из которых (A, B, C) могут вызывать вспышечные заболевания.
Передаётся возбудитель инфекции от человека к человеку воздушно-капельным путём при чихании, кашле, разговоре.
Источник инфекции – больной человек или носитель возбудителя. Наиболее опасны носители, так как они, не имея симптомов заболевания, могут заражать окружающих. Чаще всего носителями являются взрослые, даже не подозревая об этом, а болеют преимущественно дети. Заболевание регистрируется в течение года, но наибольшее количество заболевших отмечается в зимне-весенний период, сопровождая подъем заболеваемости острыми респираторными инфекциями и гриппом.
Клинические проявления менингококковой инфекции разнообразны: от локализованных форм (назофарингит) до наиболее тяжелых – генерализованных форм (менингит, менингококкцемия, эндокардит, артрит, пневмония).
Инкубационный период или период от момента заражения до появления симптомов заболевания продолжается от 1 до 10 дней (в среднем 5-7 дней).
Острый назофарингит (воспаление носоглотки) проявляется в виде заложенности носа, повышения температуры тела до 37,50С, головной боли, кашля и першения в горле. При этой форме выздоровление может наступить без лечения через 3-5 дней.
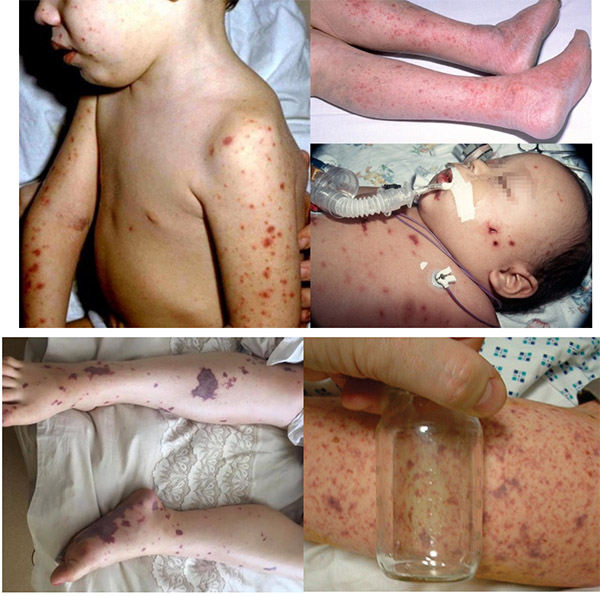 Если менингококк проникает в ликвор (спинномозговую жидкость), у заболевшего развивается воспаление мозговых оболочек или вещества мозга (менингит или менингоэнцефалит). Заболевание начинается остро, с повышения температуры тела до 39-400С, сильной головной боли, чаще распирающего характера, внезапной многократной рвоты, не приносящей больному облегчения, изменения сознания. У грудных детей отмечается напряженность или выбухание большого родничка. Характерна так называемая «менингеальная поза»: больной лежит на боку с запрокинутой назад головой и ногами, приведеными к животу. У детей старше года появляются менингеальные симптомы, которые может выявить только врач.
Если менингококк проникает в ликвор (спинномозговую жидкость), у заболевшего развивается воспаление мозговых оболочек или вещества мозга (менингит или менингоэнцефалит). Заболевание начинается остро, с повышения температуры тела до 39-400С, сильной головной боли, чаще распирающего характера, внезапной многократной рвоты, не приносящей больному облегчения, изменения сознания. У грудных детей отмечается напряженность или выбухание большого родничка. Характерна так называемая «менингеальная поза»: больной лежит на боку с запрокинутой назад головой и ногами, приведеными к животу. У детей старше года появляются менингеальные симптомы, которые может выявить только врач.
Менее распространенной, но самой тяжелой формой является менигококкцемия (менингококковый сепсис), при которой возбудитель попадает в кровь. Характерным признаком является появление звездчатой сыпи на коже нижних конечностей, ягодицах, боковых поверхностях туловища, которая не исчезает при надавливании. Заболевание быстро прогрессирует и при отсутствии лечения в 50% случаев заканчивается летальным исходом. Но даже в случаях своевременной постановки диагноза и надлежащего лечения до 16% пациентов умирают через 24-48 часов после появления симптомов, вследствие септического шока.
У взрослых наиболее часто встречаются генерализованные формы в виде менингита и менингита в сочетании с менингококкцемией, гораздо реже встречается менингоэнцефалит. К числу наиболее важных клинических симптомов у взрослых относятся: острое начало болезни, озноб, повышение температуры тела до 38-400С, боль в глазных яблоках, мышцах тела, головная боль давящего или распирающего характера, тошнота, рвота, не приносящая облегчения, единичные, мелкие элементы геморрагической сыпи на дистальных участках конечностей.
Профилактика менингококковой инфекции:
- предпочесть прогулку с ребенком на открытом воздухе и избегать поездок в общественном транспорте, а также длительно не находиться в помещениях, где имеется большое скопление людей (магазины, рынки, парикмахерские и т.д.). Все праздничные мероприятия, связанные с рождением ребенка, необходимо проводить вне квартиры, где он находится;
- при появлении первых признаков простудных заболеваний у членов семьи, необходимо соблюдать простейшие правила: «респираторный» этикет, проведение влажной уборки и проветривания помещений;
- своевременно обращаться за медицинской помощью и лечить хронические заболевания верхних дыхательных путей (тонзиллит, фарингит, ларингит). Не отказываться от проведения предложенного лабораторного обследования (мазок из носоглотки) в случае контакта с заболевшим
- предусмотреть полноценное и сбалансированное питание, обогащенное витаминами и микроэлементами, всем членам семьи, заниматься спортом, закаливанием – все это повышает защитные силы организма.
В случае появления таких симптомов, как высокая температура тела, сильная головная боль, многократная рвота, не приносящая облегчения, изменение сознания, сыпь – срочно вызвать «скорую помощь» и быстро доставить больного в больницу. Несвоевременное обращение к врачу и поздно начатое лечение, может стоить пациенту жизни. Чем раньше будет оказана квалифицированная медицинская помощь, тем успешнее и благоприятнее исход заболевания.
В Островецком районе осуществляется вакцинация против менингококковой инфекции, на платной основе, применяется вакцина «Менактра» (производство США). Для консультации и записи на вакцинацию обращайтесь к вашему участковому педиатру





 При поддержке Всемирной организации здравоохранения (далее – ВОЗ) ежегодно с 2007 года по инициативе Глобального альянса по контролю бешенства 28 сентября проводится Всемирный день борьбы против бешенства.
При поддержке Всемирной организации здравоохранения (далее – ВОЗ) ежегодно с 2007 года по инициативе Глобального альянса по контролю бешенства 28 сентября проводится Всемирный день борьбы против бешенства. 

 Островецкий районный ЦГЭ напоминает, что наступает сезон заболеваемости острыми респираторными инфекциями. Традиционно он длится – с октября по апрель.
Островецкий районный ЦГЭ напоминает, что наступает сезон заболеваемости острыми респираторными инфекциями. Традиционно он длится – с октября по апрель. Всемирная организация здравоохранения заявила, что в мире выявлен новый штамм коронавируса – Пирола (ВА.2.86). Новый вариант назван в честь кометы, вращающейся вокруг Солнца.
Всемирная организация здравоохранения заявила, что в мире выявлен новый штамм коронавируса – Пирола (ВА.2.86). Новый вариант назван в честь кометы, вращающейся вокруг Солнца.